Neste domingo (18/01/2021) a ANVISA apresentou, em tempo real, resultados e recomendações para duas vacinas contra a COVID-19, a Coronovac e a Covishield, visando a concessão das respectivas autorizações para Uso Emergencial, solicitadas por seus fabricantes, tendo como objetivo a vacinação de parcela da população brasileira.
Os resultados a seguir apresentados sumarizam a apresentação realizada pela Gerência-Geral de Medicamentos e Produtos Biológicos para a Coronavac, disponível, em sua íntegra, aqui. Em post posterior foi publicado, de igual forma, um resumo para a vacina Covishield.
Boa leitura.
Cenário Regulatório Internacional
A vacina ainda não teve seu registro sanitário aprovado em nenhum país, mas se encontra aprovada para uso emergencial na República Popular da China, Turquia e Indonésia.
Público alvo (como solicitado pela empresa)
- Trabalhadores da saúde;
- Profissionais de apoio, cuidadores de idosos, entre outros;
- População idosa (60 anos e mais);
- Pessoas com 60 anos e mais institucionalizadas;
- Pessoas com morbidades: (Diabetes mellitus; hipertensão arterial sistêmica; doença pulmonar obstrutiva crônica; doença renal; doenças cardiovasculares e cérebro vasculares; indivíduos transplantados de órgão sólido; anemia falciforme; câncer e obesidade grave (IMC≥40).
- População indígena aldeada em terras demarcadas;
- Povos e comunidades ribeirinhas;
- População em situação de rua;
- Pessoas com deficiência permanente severa;
- Trabalhadores da educação;
- Professores de nível básico ao superior;
- Pessoas envolvidas nos processos de produção e desenvolvimento de imunobiológicos estratégicos contra a Covid-19;
- Membros das Forças de Segurança e Salvamento;
- Funcionários do sistema de privação de liberdade;
- Trabalhadores do transporte coletivo;
- Transportadores rodoviários de carga;
- População privada de liberdade.
Desenvolvimento da Vacina
- Foram coletadas amostras de sangue contendo SARS-CoV-2 de quatro pacientes que foram infectados por SARS-COV-2 em diferentes regiões da China;
- Quatro cepas candidatas de SARS-CoV-2 foram isoladas, cultivadas invitro e identificadas por RT-PCR;
- Comparada a imunogenicidade pela detecção do título de anticorpos de neutralização nos soros, após a imunização de camundongos e ratos.
- A sequência genética obtida foi comparada com a sequência de referência de SARS-CoV- 2;
- Gerado o banco de célula para cultivo do vírus (célula Vero derivada do tecido de rim normal de macaco verde adulto africano);
- Estabelecimento do lote semente (mestre e de trabalho) testados pela Sinovac e pelo National Institute of Food and Drug Control (NIFDC) - China.
- Para o desenvolvimento de novo Lote de Semente Mestre, entretanto, para o Lote de Semente de Trabalho, devem ser realizados o teste de identificação, título de vírus, esterilidade e teste de micoplasma.
Controle de Qualidade do Produto a Granel, Granel Terminado, e Vacina Terminada
- Apesar de ter sido demonstrado que as especificações seguem a Farmacopeia Chinesa, esta não é reconhecida pela Anvisa, conforme a Resolução RDC n° 37, de 06/07/2009;
- Apresentado método de comparabilidade entre a Farmacopéia Européia e a Farmacopéia Chinesa;
- Apresentado cronograma de adequação para implementação dos métodos analíticos, conforme a Farmacopeia Europeia.
- O Instituto Butantan se comprometeu, uma vez tendo feito a internalização da metodologia analítica do produto terminado, em fazer o controle de qualidade de futuros lotes da vacina adsorvida covid-19 (inativada) a serem usados no contexto desta solicitação de uso emergencial.
Estabilidade do Granel e Produto Terminado
- Granel: os resultados para todos os lotes ficaram dentro das especificações nas condições de armazenamento de longa duração (5°C±3°C) por até 6 meses.
- Terminado: proposta de extrapolação para o prazo de 12 meses. Sob as seguintes condições:
- Apresentação de dados atualizados à Anvisa assim que disponíveis;
- Comunicação imediata caso seja identificado qualquer problema na estabilidade;
- Compromisso de recolhimento dos lotes em caso de identificação de problemas na estabilidade;
- Revisão das especificações para os testes de liberação e estabilidade para o granel e produto terminado;
- Avaliação da potência dos lotes de vacina importados da Sinovac (retestagem) e inclusão deste teste na liberação e estabilidade do produto terminado, caso não haja correlação entre conteúdo antigênico e potência.
Estudos Não-Clínicos realizados
- Estudo de imunogenicidade: titulação de anticorpos em camundongos;
- Estudos de desafio de vírus: para determinar a possível dosagem e cronograma da
- vacina como evidência para aplicação clínica e evidência preliminar de eficácia;
- Avaliação geral de segurança: incluindo toxicidade de dose única, toxicidade de dose repetida, anafilaxia sistêmica ativa, tolerância local e estudos de toxicidade reprodutiva.
- Conclusão: Perfil de segurança não-clínica bem caracterizado.
Estudo Clínico
- Ensaio Clínico Fase III duplo-cego, randomizado, controlado com placebo para Avaliação de Eficácia e Segurança em Profissionais da Saúde da Vacina adsorvida COVID-19 (inativada) produzida por Sinovac – PROFISCOV
- País(es) onde o estudo foi conduzido: Brasil – 16 centros de pesquisa
- Data de início e término do estudo:
- Início do estudo: 21/07/2020 Término do estudo: em andamento Data de corte: 16/12/2020
Objetivos Primários do Estudo Clínico
- Avaliar a eficácia de duas doses da Vacina adsorvida COVID-19 (inativada) em indivíduos sintomáticos com 18 anos de idade ou mais, com confirmação virológica de COVID-19, duas semanas após a segunda vacinação que trabalham como profissionais de saúde realizando atendimento em contato direto com pessoas com quadros possíveis ou confirmados de COVID-19.
- Descrever a ocorrência de reações adversas da droga associadas com a administração de cada dose da Vacina adsorvida COVID-19 (inativada) até uma semana após a vacinação em Adultos (18-59 anos de idade) e Idosos (60 anos de idade ou mais) que trabalham como profissionais de saúde realizando atendimento em contato direto com pessoas com quadros possíveis ou confirmados de COVID-19.
Objetivos Secundários do Estudo Clínico – Eficácia
- Avaliar a eficácia de duas doses da Vacina adsorvida COVID-19 (inativada) em indivíduos sintomáticos com 18 anos de idade ou mais, com confirmação virológica de COVID-19, duas semanas após a última vacinação que trabalham como profissionais de saúde (...) segundo exposição prévia a SARS-CoV-2;
- Avaliar a eficácia de pelo menos uma dose da Vacina adsorvida COVID-19 (inativada) em indivíduos sintomáticos com 18 anos de idade ou mais, com confirmação virológica de COVID- 19, duas semanas após a primeira vacinação que trabalham como profissionais de saúde (…);
- Avaliar a eficácia de duas doses de uma Vacina adsorvida COVID-19 (inativada) em infecções assintomáticas e sintomáticas por SARS-CoV-2 detectadas sorologicamente e virologicamente, duas semanas após a segunda vacinação que trabalham como profissionais de saúde (...);
- Avaliar a eficácia da Vacina adsorvida COVID-19 (inativada) em casos graves de COVID-19 confirmados virologicamente, duas semanas após receberem a segunda vacinação em indivíduos com 18 anos de idade ou mais que trabalham como profissionais de saúde (…)
Objetivos Secundários do Estudo Clínico – Imunogenicidade
- Avaliar a resposta imune à vacinação em um subgrupo de participantes duas semanas após a administração de cada dose da vacina em Adultos (18-59 anos de idade) e Idosos (60 anos de idade ou mais).
- Avaliar a resposta imune à vacinação mediada por células em um subgrupo de participantes antes de cada vacinação e às duas e quatro semanas após a administração da segunda dose da Vacina em Adultos (18-59 anos de idade) e Idosos (60 anos de idade ou mais).
- Avaliar a presença de anticorpos contra SARS-CoV-2 antes e duas semanas após a administração da segunda dose da Vacina em Adultos (18-59 anos de idade) e Idosos (60 anos de idade ou mais).
Resultado Primário de Eficácia
Eficácia total (conforme desfecho primário): 50,39% (IC 95 : 35,26 – 61,98)*
*p=0,0049
Resultado Secundário de Eficácia – Agrupamento por Gravidade
Avaliação e agrupamento de incidência de casos de acordo com a definição de gravidade da OMS
- Os casos moderados e graves foram raros ou muito raros no grupo placebo e na população PP;
- 6 participantes da população PP de análise precisaram de hospitalização;
- Nenhum participante do estudo precisou de terapia de oxigênio ou intubação.
Resultado Secundário de Eficácia – Imunogenicidade
Não foram apresentados os resultados da avaliação de imunogenicidade ao longo do tempo para esse estudo, de acordo com o que era esperado e definido no protocolo aprovado para esse estudo clínico.
- O único resultado apresentado não foi considerado adequado para avaliação e conclusão de imunogenicidade.
- Avaliações de anticorpos neutralizantes previstas: Não foram apresentados osresultados previstos no protocolo aprovado do estudo clínico.
- Avaliações de anticorpos de ligação previstas: Os dados apresentados foram referentes a uma coleta. Os resultados individuais foram apresentados em um tabela, sem tratamento de dados e sem definir a qual grupo eram referentes (Placebo ou Controle )
- Avaliação da soroconversão e da imunidade celular previstas: Não foram apresentados previstos no protocolo aprovado do estudo clínico.
- Ocorrência de reações adversas solicitadas (locais e sistêmicas) até 7 dias após a administração da segunda dose: 50,8% no grupo dos adultos e 36,4% no grupo dos idosos;
- Ocorrência de reações adversas não solicitadas (locais e sistêmicas) até 7 dias após a administração da segunda dose: 9,2% no grupo de adultos e 8,1% no grupo de idosos.
- Areaçãomaiscomumobservadadepoisdasegundadosedavacinaemambosos grupos foi dor no local da administração, que ocorreu em 40,1% dos adultos e 27,8% dos idosos;
- A grande maioria das reações adversas observadas foram de Grau 1/2 e não ocorreu nenhuma reação adversa grave;
- Outro risco ligado principalmente a vacinas inativadas é o desenvolvimento de doença agravada pela vacina (ADE).

Incertezas e Riscos
- Dados clínicos são provenientes de análises preliminares de estudos ainda em andamento;
- Não foram apresentados dados de imunogenicidade ao longo do tempo;
- A vacina não induz resposta imune celular significativa, que está mais relacionada a imunidade sustentada.Incerteza em relação à avaliação de segurança e resposta à vacina em participantes que já haviam sido previamente expostos ao vírus antes da vacinação (com comprovação sorológica);
- Qual a eficácia em indivíduos que tem infecção prévia? E qual a eficácia em indivíduos naive?
- Incertezas sobre a duração da proteção, esquema posológico e potencialização dependente de anticorpo - ADE
- Os dados são insuficientes para estabelecer conclusão ou para mostrar uma tendência de eficácia contra as formas moderadas e graves da doença Covid19.
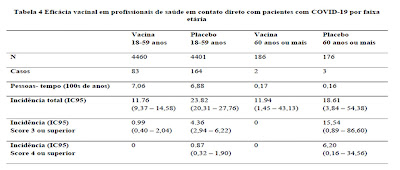
Eficácia em População Idosa
- A quantidade de idosos no estudo com dados disponíveis era muito pequeno para determinar um perfil de eficácia e segurança da vacina;
- Baixo número de casos positivos para Covid-19 em participantes com esta faixa etária (3 no braço placebo x 2 no braço vacinal);
- Imunosenescência.
Eficácia relacionada ao intervalo de dose
- Estudo Fase I/II (18 a 55 anos) conduzido com 2 intervalos distintos entre as doses, de 14 dias e de 28 dias: respostas imunológicas dos dias 0 e 28 foram maiores do que aquelas dos dias 0 e 14, independentemente da dose;
- Estudo de Fase I/II em adultos acima de 60 anos: apenas com o intervalo entre as doses de 28 dias.
- EstudodeFaseIII:intervaloentredosesde14diasa28dias
- Incertezas: Aa eficácia da vacina em pessoas com mais de 60 anos pode ser prejudicada com o intervalo de 14 dias entre as doses? A eficácia da população geral poderia ser melhor, no caso de um intervalo maior entre as doses fosse utilizado?
Eficácia para dose única, comorbidades, crianças, adolescentes, gestantes e imunossuprimidos
- Não foram apresentados dados que pudessem garantir eficácia para esse regime posológico e nem para esses grupos.
Confiabilidade e Validade Interna do Estudo
- Esclarecer quantos participantes, por braço do estudo, receberam a segunda dose da vacina com intervalo de 14 dias e quantos receberam com intervalos maiores. Nos casos intervalos maiores que 14 dias informar qual o intervalo exato entre as doses utilizado por número de participantes e por braço do estudo.
- Informar quantos pacientes sintomáticos foram detectados, e por quantas vezes, durante o estudo por centro e por braço placebo e vacinados.
- Apresentar o número de participantes sintomáticos que tiveram resultados negativos por PCR no estudo, por braço do estudo.
- Informar, por braço placebo e de vacinados, a média e a quantidade mínima e máxima de amostras coletadas para diagnóstico por PCR para os indivíduos que foram sintomáticos durante o estudo após a segunda dose da vacina.
- Narrativas com os dados dos pacientes sintomáticos considerados negativos para Covid durante o estudo após a segunda dose da vacina, incluindo descrição e data de início de sintomas, data de coleta e número de amostras coletadas para diagnóstico por PCR. Os dados devem ser apresentados por braço do estudo.
- Apresentar, quanto aos participantes do estudo positivos para COVID-19, informações sobre quantos foram hospitalizados e classificá-los individualmente de acordo com o escore de 4 a 10, para cada braço do estudo. Apresentar de forma clara quantos participantes do estudo precisaram de assistência em UTI, para o grupo controle e para o grupo vacinado.
- Descrição de todos os desvios de protocolo ocorridos no estudo, por braço do estudo, com a adequada classificação de impacto e de categoria.
- Apresentar as narrativas com os dados individuais de todos os casos COVID positivos, com descrição de dia de início de sintomas, período decorrido até a coleta de amostras, que tipo de amostras foram coletadas e quais os testes foram realizados (virológicos e sorológicos) e seus resultados. Devem ser apresentadas também a descrição da avaliação da gravidade da doença e da conclusão. Podem ser apresentados os CRF se todos os dados estiverem incluídos.
- Apresentar esclarecimentos quanto aos dados apresentados na Tabela 5 do relatório do estudo fase 3, dados sobre eficácia vacinal em 5704 profissionais de saúde em contato direto com pacientes com COVID-19 com informação sobre exposição prévia. Esclarecer quais foram as informações sobre infecção prévia avaliadas nos participantes, descrevendo os testes e comprovações apresentadas.
Agendada Inspeção de Boas Práticas Clínicas: Início 25 de Janeiro.
Recomendação à Diretoria Colegiada
- Tendo em vista o cenário da pandemia;
- Aumento do número de casos;
- Ausência de alternativas terapêuticas;
- A Gerência-Geral de Medicamentos recomenda a aprovação do uso emergencial, condicionada ao monitoramento das incertezas e reavaliação periódica.


Nenhum comentário:
Postar um comentário